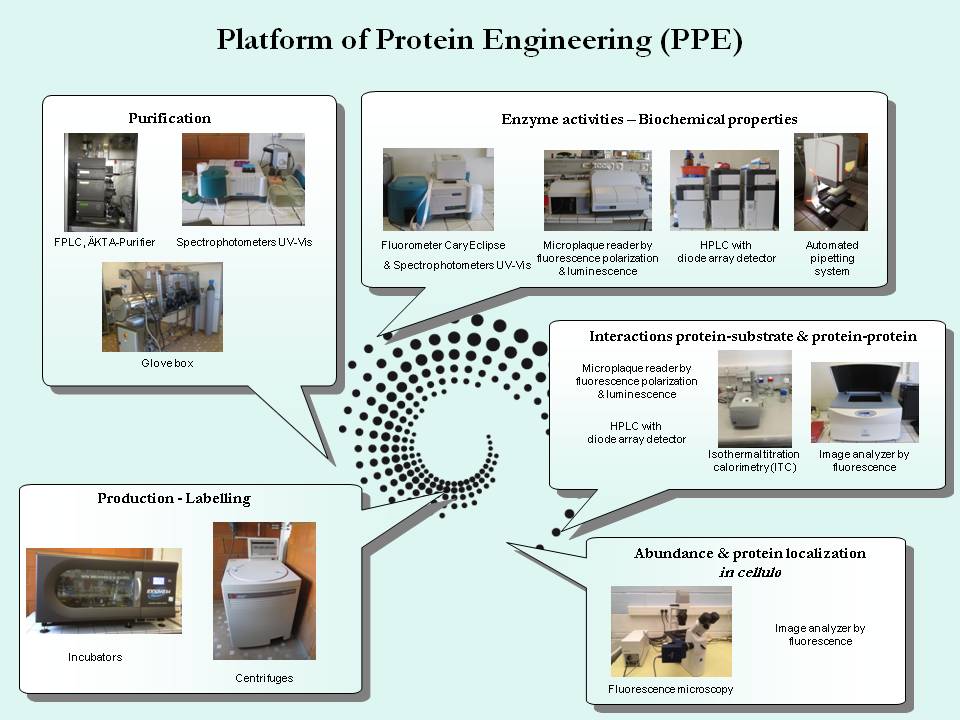
Plateau Technique d’Ingénierie Protéique (PPE) – UMR INRA-UL 1136 IAM
Responsable : Tiphaine DHALLEINE
La plateforme d’ingénierie Protéique, vise à comprendre la relation entre la structure tridimensionnelle des protéines et leurs fonctions, afin de déterminer leur rôle dans la cellule vivante. Des protéines recombinantes peuvent être produites et purifiées afin d’étudier leurs propriétés physico-chimiques, leur mécanisme d’action enzymatique ainsi que les interactions avec différents ligands. La localisation in cellulo des protéines peut également être étudiée au sein de ce plateau.
- Description des équipements :
Stations chromatographiques FPLC (ÄKTA-Purifier, GE Healthcare) et HPLC (UFLC, Shimadzu)
La FPLC (Fast Protein Liquid Chromatography) est une technologie de chromatographie liquide moyenne pression semi-automatisée. L’ÄKTA-Purifier est équipé de pompes à  pistons, d’un détecteur UV à longueur d’onde variable et d’un collecteur de fractions. Les colonnes actuellement disponibles sur le plateau sont des colonnes analytiques d’exclusion stérique Superdex 75 10/300 et Superdex 200 10/300 et les colonnes préparatives correspondantes Superdex 75 16/600 et Superdex 200 16/600. D’autres colonnes pour la chélation sur métal immobilisé, les colonnes HisTrap 1 et 5 mL, peuvent également être connectées sur l’ÄKTA-Purifier. L’appareillage, installé dans une enceinte réfrigérée à 4°C, est piloté par le logiciel Unicorn 5.2 (GE Healthcare).
pistons, d’un détecteur UV à longueur d’onde variable et d’un collecteur de fractions. Les colonnes actuellement disponibles sur le plateau sont des colonnes analytiques d’exclusion stérique Superdex 75 10/300 et Superdex 200 10/300 et les colonnes préparatives correspondantes Superdex 75 16/600 et Superdex 200 16/600. D’autres colonnes pour la chélation sur métal immobilisé, les colonnes HisTrap 1 et 5 mL, peuvent également être connectées sur l’ÄKTA-Purifier. L’appareillage, installé dans une enceinte réfrigérée à 4°C, est piloté par le logiciel Unicorn 5.2 (GE Healthcare).
L’HPLC (High Performance Liquid Chromatography) est une technologie de chromatographie liquide haute pression automatisée. L’UFLC est équipé de pompes à pistons, d’un injecteur automatique d’échantillons, d’un collecteur de fractions, d’un four pour colonne et de deux détecteurs : un détecteur UV-visible à longueur d’onde variable et un détecteur à barrette de diodes permettant d’analyser les spectres UV-visibles des constituants chromatographiés. Les colonnes actuellement disponibles sur le plateau sont des colonnes de phase inversées analytiques Gemini C18 5 µm 150 x 3 mm, Kinetex Biphenyl 5 µm 250 x 4,6 mm, Kinetex C18 2,6 µm 100 x 4,6 mm, Jupiter C18 5 µm 250 x 4,6 mm et les colonnes préparatives correspondantes Gemini C18 5 µm 250 x 10 mm, Kinetex Biphenyl 5 µm 250 x 10 mm. Une colonne d’exclusion stérique, BioSep-SEC S3000300 x 7,8 mm, peut également être connectée sur l’HPLC. L’appareillage UFLC est piloté avec le logiciel LC-LabSolutions (Shimadzu).
Boîte à gants (GP[Concept], Jacomex)
La boîte à gants est une enceinte étanche qui permet de manipuler dans une atmosphère sous azote, en absence d’oxygène. Des gants, fixés à une des parois, permettent d’accéder à l’intérieur sans que le confinement cesse. Des SAS d’entrée-sortie, de capacités différentes, permettent les échanges avec l’extérieur.
Appareils de fluorimétrie CaryEclipse (Varian) et lecteur de microplaque Victor X5 (Perkin Elmer).
Le spectrophotomètre à fluorescence CaryEclipse permet de déterminer la concentration de certains composés fluorescents et de suivre des cinétiques enzymatiques dans une gamme de 200 à 900 nm. Cet instrument possède une lampe à xénon. Il est contrôlé par le logiciel CaryEclipse ADL Shell Application (Varian).
fluorescents et de suivre des cinétiques enzymatiques dans une gamme de 200 à 900 nm. Cet instrument possède une lampe à xénon. Il est contrôlé par le logiciel CaryEclipse ADL Shell Application (Varian).
Le lecteur Victor X5 est un lecteur de microplaque dont la détection est basée sur  l’émission et l’absorption de lumière, comprenant la luminescence, la fluorescence, l’absorbance (visible et UV), la fluorescence en temps résolu et la fluorescence polarisée. Une roue porte différents filtres d’excitation et d’émission permettant de sélectionner une longueur d’onde d’intérêt. Le lecteur est piloté avec le logiciel Perkin-Elmer 2030 4.00.
l’émission et l’absorption de lumière, comprenant la luminescence, la fluorescence, l’absorbance (visible et UV), la fluorescence en temps résolu et la fluorescence polarisée. Une roue porte différents filtres d’excitation et d’émission permettant de sélectionner une longueur d’onde d’intérêt. Le lecteur est piloté avec le logiciel Perkin-Elmer 2030 4.00.
 Analyseur d’images Odyssey (Li-COR)
Analyseur d’images Odyssey (Li-COR)
Le scanner Odyssey est un système d’imagerie dans l’infrarouge et le proche infrarouge qui permet d’analyser des gels de protéines, d’ADN et des Western-Blot. L’appareil est piloté avec le logiciel Odyssey 3.0 (LI-COR).
Calorimétrie à titrage isotherme (MicroCal ITC200, GE Healthcare)
Le système de titrage calorimétrique isotherme (ITC) MicroCal ITC200 est utilisé pour étudier une large gamme d’interactions entre des biomolécules. Cet app areillage permet des mesures directes, sans marquage et en solution, de l’affinité de liaison, de la stœchiométrie et des paramètres thermodynamiques de l’interaction entre deux composés, en une unique expérience. Un de deux composés est placé dans une cellule dont la température est régulée tandis que l’autre composé est prélevé avec une seringue motorisée et injecté en plusieurs volumes successifs dans la cellule sous agitation. La mesure de la chaleur dégagée (réaction exothermique) ou captée (réaction endothermique) lors de l’interaction permet de caractériser la thermodynamique du système. Le système est contrôlé par le logicielMicroCal ITC200.
areillage permet des mesures directes, sans marquage et en solution, de l’affinité de liaison, de la stœchiométrie et des paramètres thermodynamiques de l’interaction entre deux composés, en une unique expérience. Un de deux composés est placé dans une cellule dont la température est régulée tandis que l’autre composé est prélevé avec une seringue motorisée et injecté en plusieurs volumes successifs dans la cellule sous agitation. La mesure de la chaleur dégagée (réaction exothermique) ou captée (réaction endothermique) lors de l’interaction permet de caractériser la thermodynamique du système. Le système est contrôlé par le logicielMicroCal ITC200.
Microscopie à fluorescence  (microscope inversé Axio Vert A1, ZEISS)
(microscope inversé Axio Vert A1, ZEISS)
Le microscope inversé Axio Vert A1 est un microscope à fluorescence LED (lumière transmise entre 400 et 700 nm) pour l’observation de cellules grâce aux différentes techniques de contraste qui peuvent être mise en œuvre. L’appareil est équipé d’une caméra Jenoptik ProgGres et le système est contrôlé par le logiciel ProgRes CapturePro 2.8.8 (ZEISS).
- Modalités d’utilisation des équipements :
Le plateau PPE est accessible du lundi au vendredi sur rendez-vous auprès de la responsable. Il est localisé au sein de l’UMR 1136 (entrée 1B, niveau 3) à la Faculté des Sciences et Technologies à Vandœuvre-lès-Nancy.
Responsable du plateau PPE :
Tiphaine DHALLEINE, Ingénieur d’Études, UMR INRA-UL 1136 IAM, Faculté des Sciences et Technologies UL, 54500 Vandœuvre-lès-Nancy, Tel 03 83 68 42 27, E-mail : tiphaine.dhalleine@univ-lorraine.fr
Activités :
Appareils de chromatographies FPLC (ÄKTA-Purifier, GE Healthcare) et HPLC (UFLC, Shimadzu)
La FPLC permet de purifier les protéines soit en fonction de la taille par chromatographie d’exclusion stérique (SEC), soit en fixant leur Tag Histidine sur nickel immobilisé sur une résine (IMAC), ou encore en fonction de leur état de charge par échange d’ions (IEC).
La technologie HPLC a plutôt vocation à doser et à purifier des petites molécules telles que les extractibles de plantes et les produits de réactions enzymatiques sur colonne de phase inversée (RP-HPLC).
Boîte à gants (GP[Concept], Jacomex)
La boîte à gants permet de manipuler sous azote, dans une atmosphère exempte d’oxygène, afin de préserver certaines protéines s’oxydant spontanément à l’air (telles que les protéines à centre fer-soufre et certaines enzymes d’oxydo-réduction).
Appareils de fluorimétrie CaryEclipse (Varian) et lecteur de microplaque Victor X5 (Perkin Elmer)
Ces systèmes sont utilisés pour le dosage de protéines fluorescentes (marquées par une sonde telle que l’ANS, ou conjuguées à la GFP ou à la mCherry). Ils permettent également de réaliser des tests d’activité enzymatique. Le système Victor, qui permet la lecture de microplaques, est adapté pour l’analyse d’un grand nombre d’échantillons.
Analyseur d’images Odyssey (Li-COR)
Les applications possibles sur l’Odyssey sont multiples. Outre les traditionnelles visualisations de Western-blot sur membrane PVDF ou nitrocellulose, cet appareil permet la visualisation et la quantification des marquages (simples ou doubles) directement sur gel (In-Gel Western-blot).
Calorimétrie à titrage isotherme (MicroCal ITC200, GE Healthcare)
Ce système permet de déterminer les paramètres d’affinité de l’interaction entre deux composés (protéines-protéines, protéines-ions métalliques, protéines-petites molécules, etc.) tels que la constante de dissociation (Kd), la stœchiométrie de réaction (n) ainsi que les paramètres thermodynamique de la réaction tels que l’enthalpie (∆H), l’énergie libre de Gibbs (∆G), et l’entropie (∆S). Ces paramètres renseignent sur la nature chimique de l’interaction (liaisons de Van der Waals, liaisons hydrogène, liaisons hydrophobes et désolvatation).
Microscopie à fluorescence (microscope inversé Axio Vert A1, ZEISS)
La microscopie à fluorescence permet de détecter et de localiser une protéine fluorescente dans une cellule vivante transformée ou dans un extrait végétal marqué et de la quantifier éventuellement.
Missions :
Mettre à disposition des chercheurs partenaires, les équipements du plateau PPE et l’expertise méthodologique nécessaire au développement des projets.
Contribuer au rayonnement scientifique de l’unité de recherche en répondant aux besoins des collaborations scientifiques engagées.
Intégrer des réseaux d’utilisateurs et développer des interactions avec d’autres plateaux technologiques afin d’enrichir l’expertise et de remédier aux problèmes techniques rencontrés. Faire de la veille technologique et prévoir les investissements futurs.
Spécificités :
Le plateau PPE est intégré dans l’équipe Redox de l’UMR INRA-UL 1136 IAM localisée à la faculté des sciences et technologies de l’UL, à Vandœuvre-lès-Nancy.
L’Unité de Recherche IAM fait partie du pôle scientifique A2F (Agronomie, Agroalimentaire & Forêt) qui regroupe six laboratoires de recherche fédérés au sein de l’institut fédératif EFABA (Ecosystèmes Forestiers, Agroressources, Biomolécules et Alimentation). Le pôle A2F s’appuie sur des associations fortes avec l’INRA et un partenariat avec AgroParisTech. Les deux axes majeurs du secteur sont d’une part la forêt et le bois et d’autre part l’agronomie et l’agroalimentaire. Ces axes se retrouvent dans un pôle de compétence du ministère de l’agriculture et de la pêche et du ministère de l’enseignement supérieur et de la recherche, intitulé FABELOR (Forêt – Agroalimentaire – biotechnologie – Environnement en Lorraine). La partie Forêt Bois est structurée autour du laboratoire d’excellence ARBRE (LabEx ARBRE).
Le plateau PPE interagira fortement avec la future plateforme ASIA (Approches fonctionnelles et Structurales des InterActions cellulaires) soutenue par les laboratoires du pôle A2F localisés à la faculté des sciences et techniques.